Geben Sie ein Wort oder eine Phrase in einer beliebigen Sprache ein 👆
Sprache:
Übersetzung und Analyse von Wörtern durch künstliche Intelligenz ChatGPT
Auf dieser Seite erhalten Sie eine detaillierte Analyse eines Wortes oder einer Phrase mithilfe der besten heute verfügbaren Technologie der künstlichen Intelligenz:
- wie das Wort verwendet wird
- Häufigkeit der Nutzung
- es wird häufiger in mündlicher oder schriftlicher Rede verwendet
- Wortübersetzungsoptionen
- Anwendungsbeispiele (mehrere Phrasen mit Übersetzung)
- Etymologie
Was (wer) ist Гемоглобин - definition
ГРУППА ЖЕЛЕЗОСОДЕРЖАЩИХ БЕЛКОВ ЖИВОТНЫХ, КОТОРЫЕ ОБЕСПЕЧИВАЮТ ПЕРЕНОС КИСЛОРОДА В ТКАНИ
Метгемоглобин; Гемоглобины; Оксигемоглобин; Метагемоглобин; Hb
ГЕМОГЛОБИН
(от гемо ... и лат. globus - шар), красный дыхательный пигмент крови человека, позвоночных и некоторых беспозвоночных животных. Состоит из белка (глобина) и железопорфирина - гема. Переносит кислород от органов дыхания к тканям и углекислый газ от тканей к дыхательным органам. У различных видов организмов гемоглобин имеет разное строение. Многие заболевания крови (анемии) связаны с нарушениями строения гемоглобина, в т. ч. наследственными.
гемоглобин
м.
Красный железосодержащий пигмент крови, осуществляющий перенос кислорода из легких в ткани организма.
Красный железосодержащий пигмент крови, осуществляющий перенос кислорода из легких в ткани организма.
Гемоглобин
(Hb)
(от гемо... (См. Гемо...) и лат. globus - шар), красный железосодержащий пигмент крови человека, позвоночных и некоторых беспозвоночных животных; в организме выполняет функцию переноса кислорода (O2) из органов дыхания к тканям; играет также важную роль в переносе углекислого газа от тканей в органы дыхания. У большинства беспозвоночных Г. свободно растворён в крови; у позвоночных и некоторых беспозвоночных находится в красных кровяных клетках - эритроцитах, составляя до 94\% их сухого остатка. Молярная масса Г., включенного в эритроциты, около 66 000, растворённого в плазме - до 3000000. По химической природе Г. - сложный белок - хромопротеид (См. Хромопротеиды), состоящий из белка глобина и железопорфирина - гема. У высших животных и человека Г. состоит из 4 субъединиц-мономеров с молярной массой около 17000; два мономера содержат по 141 остатку аминокислот (α-цепи), два других - по 146 остатков (β-цепи).
Пространственные структуры этих полипептидов во многом аналогичны. Они образуют характерные "гидрофобные карманы", в которых размещены молекулы гема (по одной на каждую субъединицу). Из 6 координационных связей атома железа, входящего в состав гема, 4 направлены на азот пиррольных колец; 5-я соединена с азотом имидазольного кольца гистидина, принадлежащего полипептидам и стоящего на 87-м месте в α-цепи и на 92-м месте в β-цепи; 6-я связь направлена на молекулу воды или др. группы (лиганды) и в том числе на кислород. Субъединицы рыхло связаны между собой водородными, солевыми и др. нековалентными связями и легко диссоциируют под влиянием амидов, повышенной концентрации солей с образованием главным образом симметричных димеров (αβ) и частично α- и β-мономеров. Пространственная структура молекулы Г. изучена методом рентгеноструктурного анализа (М. Перуц, 1959).
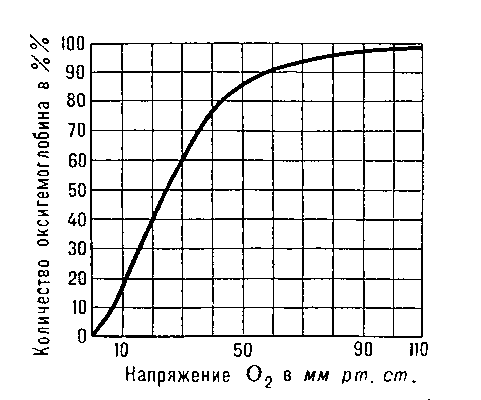
Последовательность расположения аминокислот в α- и β-цепях Г. ряда высших животных и человека полностью выяснена. В собранной в тетрамер молекуле Г. все 4 остатка гема расположены на поверхности и легко доступны реакции с O2. Присоединение O2 обеспечивается содержанием в геме атома Fe2+. Эта реакция обратима и зависит от парциального давления (напряжения) O2. В капиллярах лёгких, где напряжение O2 около 100 мм рт. ст., Г. соединяется с O2 (процесс оксигенации), превращаясь в оксигенированный Г. - оксигемоглобин. В капиллярах тканей, где напряжение O2 значительно ниже (ок. 40 мм рт. ст.), происходит диссоциация оксигемоглобина на Г. и O2; последний поступает в клетки органов и тканей, где парциальное давление O2 ещё ниже (5-20 мм рт. cm.); в глубине клеток оно падает практически до нуля. Присоединение O2 к Г. и диссоциация оксигемоглобина на Г. и O2 сопровождаются конформационными (пространственными) изменениями молекулы Г., а также его обратимым распадом на димеры и мономеры с последующей агрегацией в тетрамеры.
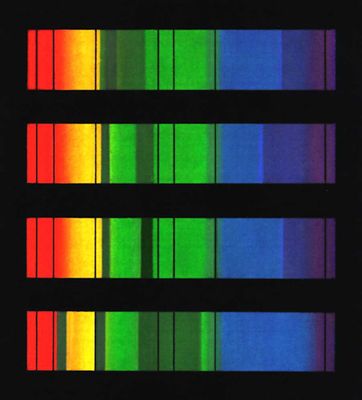
Изменяются при реакции с O2 и др. свойства Г.: оксигенированный Г. - в 70 раз более сильная кислота, чем Г. Это играет большую роль в связывании в тканях и отдаче в лёгких CO2. Характерны полосы поглощения в видимой части спектра: у Г. - один максимум (при 554 ммк), у оксигенированного Г. - два максимума при 578 и 540 ммк. Г. способен непосредственно присоединять CO2 (в результате реакции CO2 с NH2-rpyппами глобина); при этом образуется карбгемоглобин - соединение неустойчивое, легко распадающееся в капиллярах лёгких на Г. и CO2.
Количество Г. в крови человека - в среднем 13-16 г\% (или 78\%-96\% по Сали); у женщин Г. несколько меньше, чем у мужчин. Свойства Г. меняются в онтогенезе. Поэтому различают Г. эмбриональный, Г. - плода (foetus) - HbF, Г. взрослых (adult) - HbA. Сродство к кислороду у Г. плода выше, чем у Г. взрослых, что имеет существенное физиологическое значение и обеспечивает большую устойчивость организма плода к недостатку O2. Определение количества Г. в крови имеет важное значение для характеристики дыхательной функции крови в нормальных условиях и при самых различных заболеваниях, особенно при болезнях крови. Количество Г. определяют специальными приборами - гемометрами.
При некоторых заболеваниях, а также при врождённых аномалиях крови (см. Гемоглобинопатии) в эритроцитах появляются аномальные (патологические) Г., отличающиеся от нормальных замещением аминокислотного остатка в (- или β-цепях. Выделено более 50 разновидностей аномальных Г. Так, при серповидноклеточной анемии обнаружен Г., в β-цепях которого глутаминовая кислота, стоящая на 6-м месте от N-koнца, замещена валином. Аномалии эритроцитов, связанные с содержанием гемоглобина F или Н, лежат в основе талассемии (См. Талассемия), метгемоглобинемии (См. Метгемоглобинемия). Дыхательная функция некоторых аномальных Г. резко нарушена, что обусловливает различные патологические состояния (анемии (См. Анемия) и др.). Свойства Г. могут меняться при отравлении организма, например угарным газом, вызывающим образование Карбоксигемоглобина, или ядами, переводящими Fe2+ гема в Fe3+ с образованием метгемоглобина. Эти производные Г. не способны переносить кислород. Г. различных животных обладают видовой специфичностью, обусловленной своеобразием строения белковой части молекулы. Г., освобождающийся при разрушении эритроцитов, - источник образования жёлчных пигментов (См. Жёлчные пигменты).
В мышечной ткани содержится мышечный Г. - Миоглобин, по молярной массе, составу и свойствам близкий к субъединицам Г. (мономерам). Аналоги Г. обнаружены у некоторых растений (например, Леггемоглобин содержится в клубеньках бобовых).
Лит.: Коржуев П. А., Гемоглобин, М., 1964; Гауровиц Ф., Химия и функции белков, пер. с англ., 2 изд., М., 1965, с. 303-23; Ингрэм В., Биосинтез макромолекул, пер. с англ., М., 1966, с. 188-97; Рапопорт С. М., Медицинская биохимия, пер. с нем., М., 1966; Перутц М., Молекула гемоглобина, в сборнике: Молекулы и клетки, М., 1966; Цукеркандль Э.; Эволюция гемоглобина, там же; Fanelli A. R., AntoniniE., Caputo A., Hemoglobin and myoglobin, "Advances in Protein Chemistry", 1964, v. 19, p. 73-222; Antonini Е., Brunori M., Hemoglobin, "Annual Review of Biochemistry", 1970, v. 39, p. 977-1042.
Г. В. Андреенко, С. Е. Северин.

Спектры поглощения гемоглобина и его соединений: 1 - гемоглобин; 2 - оксигемоглобин; 3 - карбоксигемоглобин; 4 - метгемоглобин: B, C, D, E, F, G - основные фраунгоферовы линии солнечного спектра, цифрами обозначены длины волн.
Кривая диссоциации оксигемоглобина человека.
Wikipedia
Гемоглобин

Гемоглоби́н (от др.-греч. αἷμα «кровь» + лат. globus «шар») (Hb или Hgb) — сложный железосодержащий белок животных, обладающих кровообращением, способный обратимо связываться с кислородом, обеспечивая его перенос в ткани. У позвоночных животных содержится в эритроцитах, у большинства беспозвоночных растворён в плазме крови (эритрокруорин) и может присутствовать в других тканях. Молекулярная масса гемоглобина человека — около 66,8 кДа. Молекула гемоглобина может нести до четырёх молекул кислорода. Один грамм гемоглобина может переносить до 1,34 мл кислорода.
Beispiele aus Textkorpus für Гемоглобин
1. Низкий гемоглобин - это нескончаемая изнурительная слабость, анемичность.
2. Голос крови "Красная кровь": гемоглобин, эритроциты, гематокрит.
3. Гемоглобин у меня всегда маленький, беспокоиться нечего.
4. Гемоглобин в организме человека играет огромную роль.
5. Например, синтетический гемоглобин или гормоны роста.






